
联系我们
产品目录
产品知识/technial
阅读次数:165 发布时间:2022/4/1 14:38:07
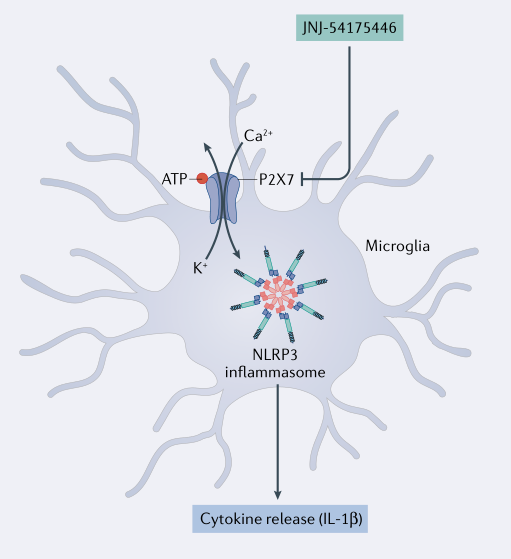
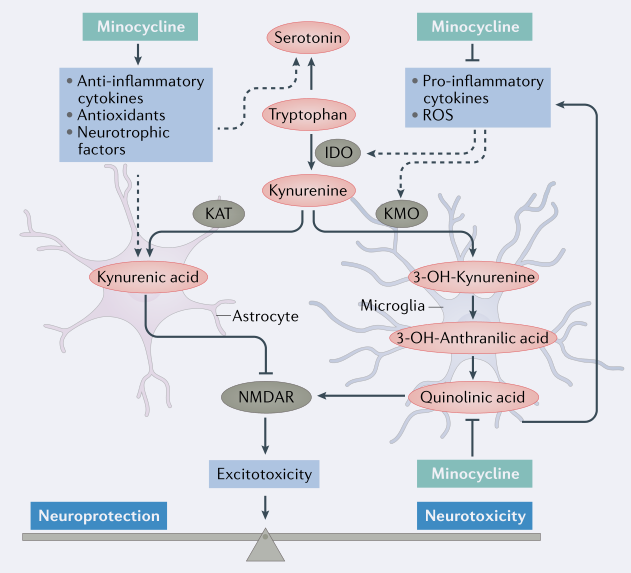
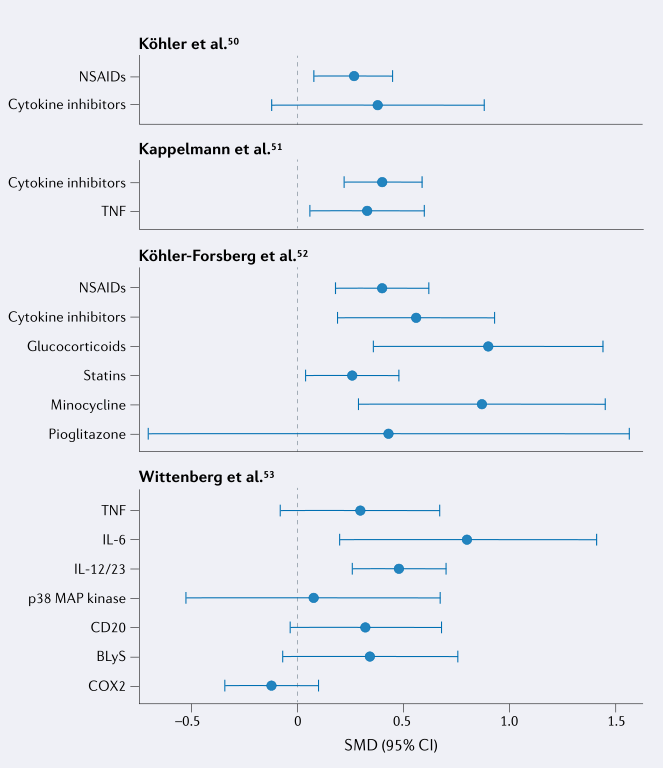
| 相关产品 |
| TNF-α-IN-1 is an inhibitor of TNF-α. |
| IL-17A antagonist 3 is an IL-17A antagonist. |
| Human TNF alpha (46-65) peptide. |
| IL-17A inhibitor 1 (example 24) is an inhibitor of IL-17A. |
| LMT-28 is an orally active and the first synthetic IL-6 inhibitor. That functions through direct binding to gp130. LMT-28 displays low toxicity and selectively inhibits IL-6–induced phosphorylation of STAT3, JAK2, and gp130. |
参考资料
1.Drevets, W.C., Wittenberg, G.M., Bullmore, E.T. et al. Immune targets for therapeutic development in depression: towards precision medicine. Nat Rev Drug Discov 21, 224–244 (2022). https://doi.org/10.1038/s41573-021-00368-1
2.Warden, D., Rush, A. J., Trivedi, M. H., Fava, M. & Wisniewski, S. R. The STAR* D Project results: a comprehensive review of findings. Curr. Psychiatry Rep. 9, 449–459 (2007).
3. Uher, R. et al. An inflammatory biomarker as a differential predictor of outcome of depression treatment with escitalopram and nortriptyline. Am. J. Psychiatry 171, 1278–1286 (2014).
4. Haroon, E. et al. Antidepressant treatment resistance is associated with increased inflammatory markers in patients with major depressive disorder. Psychoneuroendocrinology 95, 43–49 (2018).
5. Miller, A. H. & Raison, C. L. The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nat. Rev. Immunol. 16, 22–34 (2016).
6. Branchi, I. et al. Brain-immune crosstalk in the treatment of major depressive disorder. Eur. Neuropsychopharmacol. 45, 89–107 (2020).
7. Felger, J. C. Role of inflammation in depression and treatment implications. Handb. Exp. Pharmacol. 250, 255–286 (2018).
8. Khandaker, G. M., Pearson, R. M., Zammit, S., Lewis, G. & Jones, P. B. Association of serum interleukin 6 and C-reactive protein in childhood with depression and psychosis in young adult life: a population-based longitudinal study. JAMA Psychiatry 71, 1121–1128 (2014).
9. Bell, J., Kivimäki, M., Bullmore, E., Steptoe, A. & Carvalho, L. Repeated exposure to systemic inflammation and risk of new depressive symptoms among older adults. Transl. Psychiatry 7, e1208 (2017).
10. Chiu, W., Su, Y., Su, K. & Chen, P. Recurrence of depressive disorders after interferon-induced depression. Transl. Psychiatry 7, e1026 (2017).
11. DNelson, M. R. et al. The support of human genetic evidence for approved drug indications. Nat. Genet. 47, 856–860 (2015).
12. Wray, N. R. et al. Genome-wide association analyses identify 44 risk variants and refine the genetic architecture of major depression. Nat. Genet. 50, 668 (2018).
13. Bull, S. et al. Functional polymorphisms in the interleukin-6 and serotonin transporter genes, and depression and fatigue induced by interferon-α and ribavirin treatment. Mol. Psychiatry 14, 1095–1104 (2009).
原创作者:上海陶术生物科技有限公司